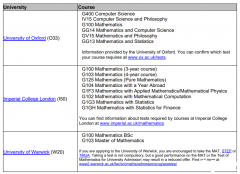
发布时间:2024-03-26 12:14:11 编辑:小妹来源:网络
A-Level化学学习中的常见规律和要点总结!对于许多正在学习A-Level化学的学生来说,掌握核心规律和要点是巩固知识基础和提升学习效果的关键。为了帮助大家更好地复习和巩固A-Level化学知识,新小编特地为大家总结了化学学习中的一些重要规律和要点。
1、在惰性电极上,各种离子的放电顺序:
阴极(夺电子的能力):Au3+ >Ag+>Hg2+ >Cu2+ >Pb2+ >Fa2+ >Zn2+ >H+ >Al3+>Mg2+ >Na+ >Ca2+ >K+
阳极(失电子的能力):S2- >I- >Br–>Cl- >OH- >含氧酸根
注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au除外)

Alevel化学考点
2、双水解离子方程式的书写:(1)左边写出水解的离子,右边写出水解产物;
(2)配平:在左边先配平电荷,再在右边配平其它原子;(3)H、O不平则在那边加水。
例:当Na2CO3与AlCl3溶液混和时: 3 CO32- + 2Al3+ + 3H2O = 2Al(OH)3↓+ 3CO2↑
3、写电解总反应方程式的方法:(1)分析:反应物、生成物是什么;(2)配平。
例:电解KCl溶液:2KCl + 2H2O == H2↑+ Cl2↑+ 2KOH 配平:2KCl + 2H2O == H2↑+ Cl2↑+ 2KOH
4、将一个化学反应方程式分写成二个电极反应的方法:(1)按电子得失写出二个半反应式;(2)再考虑反应时的环境(酸性或碱性);(3)使二边的原子数、电荷数相等。
例:蓄电池内的反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O 试写出作为原电池(放电)时的电极反应。
写出二个半反应:Pb –2e- →PbSO4 PbO2 +2e- →PbSO4
分析:在酸性环境中,补满其它原子: 应为: 负极:Pb + SO42- -2e- = PbSO4
正极:PbO2 + 4H+ + SO42- +2e- = PbSO4 + 2H2O
注意:当是充电时则是电解,电极反应则为以上电极反应的倒转:
为: 阴极:PbSO4 +2e- = Pb + SO42- 阳极:PbSO4 + 2H2O -2e- = PbO2 + 4H+ + SO42-
5、在解计算题中常用到的恒等:原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等,用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法 和估算法。(非氧化还原反应:原子守恒、电荷 平衡、物料平衡用得多,氧化还原反应:电子守恒用得多)
6、电子层结构相同的离子,核电荷数越多,离子半径越小;
7、晶体的熔点:原子晶体>离子晶体>分子晶体 中学学到的原子晶体有:Si、SiC 、SiO2=和金刚石。 原子晶体的熔点的比较是以原子半径为依据的: 金刚石> SiC > Si (因为原子半径:Si> C> O).
8、分子晶体的熔、沸点:组成和结构相似的物质,分子量越大熔、沸点越高。
9、胶体的带电:一般说来,金属氢氧化物、金属氧化物的胶体粒子带正电,非金属氧化物、金属硫化物 的胶体粒子带负电。
上面就是关于Alevel化学考点的总结,希望对大家有一定的帮助,大家最好在考前做好复习准备,如果发现自己的学习弱点可以联系新航道北京学校的老师,我们会及时为您解决学习上的问题。
犀牛ALevel课程安排
除了针对本次大考所设置的ALevel考前冲刺课程之外, 犀牛这边目前还有常规的ALevel课程,包含ALevel预习班课程、ALevel同步培训班、ALevel全日制课程,帮助不同阶段的同学备考提升,冲刺A*。
ALevel预习班
针对学生:即将就读AS或A2,提前预习ALevel知识,以适应开学课程节奏的学生
课程内容:ALevel基础知识点讲解、模块化的练习题目、题目讲解以及阶段性测试,以更好地衔接开学后的学习。
ALevel同步培训班
针对学生:与课内同步进行提升的AS/A2在读学生。
课程内容:ALevel同步培优课程紧密跟进学校的教学进程,系统梳理和讲解课内知识的重点和难点,同时进行一定的知识拓展,帮助学生掌握课内知识,并培养学生解决中等难度问题的能力。
ALevel全日制课程
2年制ALevel课程:3-6人小班教学,4科+选修,9月入学
1.5年制ALevel课程:3-6人小班授课,4科,6月/12月入学
1年制ALevel课程:3-6人小班授课,4科,9月入学
ALevel培训课程及学习规划
在线客服咨询
AP03-08


小托福04-03

美国留学04-05